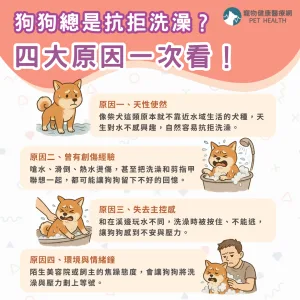
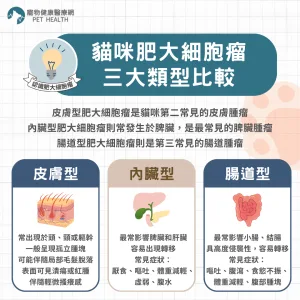
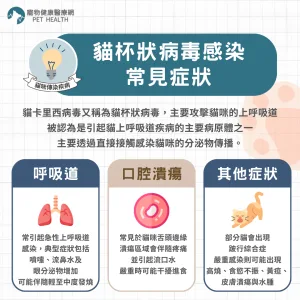
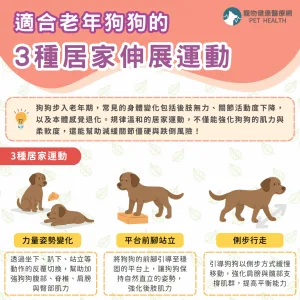
美國食品藥物管理局(FDA)於2026年1月16日正式公告,核准Anivive Lifesciences研發的口服藥品Laverdia-CA1(verdinexor)為全球首款針對犬隻淋巴瘤的全口服療法,代表該藥物在歷經四年條件式審查後,終於完成其療效完整性評估,取得全面上市資格。
文章目錄
口服劑型提升治療便利性與順從性,減少就診壓力
Laverdia-CA1的問世為犬隻淋巴瘤的治療模式帶來革命性突破。相較以往需至動物醫院進行靜脈化療,該藥採口服錠劑設計,由飼主在家即可依照獸醫師指示進行投藥,有效減輕犬隻因頻繁就診所產生的緊迫感,同時大幅降低飼主的照護負擔。
依據核准使用指引,Laverdia-CA1建議每週服用兩次,每次間隔至少72小時,並應於犬隻進食後立即給藥,以提升藥物的吸收效率並確保療效穩定發揮。此便利性不僅強化治療順從性,也讓患病犬隻能在熟悉且安心的家庭環境中,穩定展開抗癌療程。
藥物如何作用?鎖定腫瘤細胞核輸出機制,精準誘導細胞凋亡
Laverdia-CA1的主要活性成分為verdinexor,為一種選擇性核輸出抑制劑(Selective Inhibitor of Nuclear Export, SINE),其作用標的是細胞中的CRM1(Chromosome Region Maintenance 1,又稱XPO1)通道。此機制可有效阻斷腫瘤抑制蛋白(Tumor Suppressor Proteins, TSP)與增殖調控蛋白(Growth Regulatory Proteins, GRP)由細胞核外運輸至細胞質的過程,使關鍵調控蛋白得以留存於細胞核內,發揮其應有的抑癌與細胞週期控制功能。
透過此精準機制,verdinexor展現對腫瘤細胞的選擇性毒殺作用,誘導癌細胞進入凋亡路徑,同時對正常細胞則相對保留其功能與活性。該藥的分子設計特性,使其成為當前獸醫領域中少數具靶向作用機轉的創新抗腫瘤口服藥物之一,為犬隻淋巴瘤治療帶來更精準與個別化的療法選擇。
臨床試驗揭示治療效果,但反應時間不一
根據FDA審查所採用的臨床試驗數據,Laverdia-CA1於一項多中心、開放標籤、單臂設計的實地研究中評估其對犬隻淋巴瘤的治療效益。試驗共納入58隻患有新診斷(n=35)或首次復發(n=23)的犬隻,經verdinexor治療後,整體客觀反應率(Objective Response Rate, ORR)為34.5%(20/58),包含部分與完全緩解個案。
進一步分析顯示,29%(17/58)犬隻的病程控制時間(Time to Progression, TTP)超過56天,其中更有3隻犬隻病情穩定超過182天。然而,整體研究族群的中位TTP僅為29.5天,說明藥物雖能為部分個體帶來明顯效益,其整體治療持續性與反應時間具高度異質性。
因此,Laverdia-CA1在臨床應用上更適合作為輔助性療法或轉換治療期的橋接選項,特別適用於等待其他化療計畫啟動、或飼主希望於家中穩定控制病情之犬隻患者。其治療反應高度依賴個體耐受性與腫瘤亞型,臨床獸醫需根據患者條件謹慎選擇與評估治療策略。
副作用與接觸風險需注意,使用須遵照指引
如同多數癌症用藥,Laverdia-CA1具潛在嚴重副作用,包括厭食、體重下降、嘔吐、腹瀉與嗜睡等,部分個案出現血球異常與腎臟蛋白流失現象。根據仿單建議,使用前需密切監測血液數據與生化指標。
此外,FDA特別強調Laverdia為人類可能具生殖毒性的藥物,孕婦、哺乳婦女與兒童嚴禁接觸藥品或經治療犬隻的排泄物。服藥期間與停藥後三天內,飼主需配戴抗化療手套清理犬隻排泄物,並將相關廢棄物密封處理,以避免人畜交叉風險。
儘管Laverdia-CA1目前僅於美國核准,但此類創新獸醫腫瘤藥品為台灣未來引進提供嶄新藍圖,對應高齡犬隻與癌症發生率日益攀升的趨勢。

作者 – 寵物健康醫療網
寵物健康醫療網致力於打造台灣最健全的寵物專屬健康平台,提供最新的醫療指引、寵物健康知識與產業動態。